- Apotheken-Notdienst
-
Podcast: "gecheckt!"
- Podcasts: Allergien
- Podcasts: Apotheke
- Podcasts: Arzneimittel
- Podcasts: Baby und Familie
- Podcasts: Diabetes
- Podcasts: Erkältung
- Podcasts: Ernährung
- Podcasts: Frauengesundheit
- Podcasts: Gesund leben
- Podcasts: Haut & Haare
- Podcasts: Magen-Darm
- Podcasts: Männergesundheit
- Podcasts: Medizin
- Podcasts: Naturheilkunde
- Podcasts: Psychologie
- Podcasts: Sport & Bewegung
- Podcasts: Zähne
- Podcast: Was ist das überhaupt?
- Newsletter
- Apotheke
- Medizin
- Naturheilkunde
- Ernährung
- Sport & Wellness
- Jung & Alt
- Frau & Mann
- Gesellschaft
- Service
- Gewinnspiel
- Das Apotheken Magazin
Covid-19-Totimpfstoff: Zulassung für Novavax steht bevor
Die Europäische Arzneimittelagentur (EMA) hat sich für eine bedingte Zulassung des Covid-19-Impfstoffs Nuvaxovid® von Novavax ausgesprochen. Sobald die EU-Kommission zugestimmt hat, steht damit erstmals ein proteinbasierter Corona-Impfstoff in Europa zur Verfügung. Landläufig wird er auch als Totimpfstoff bezeichnet.
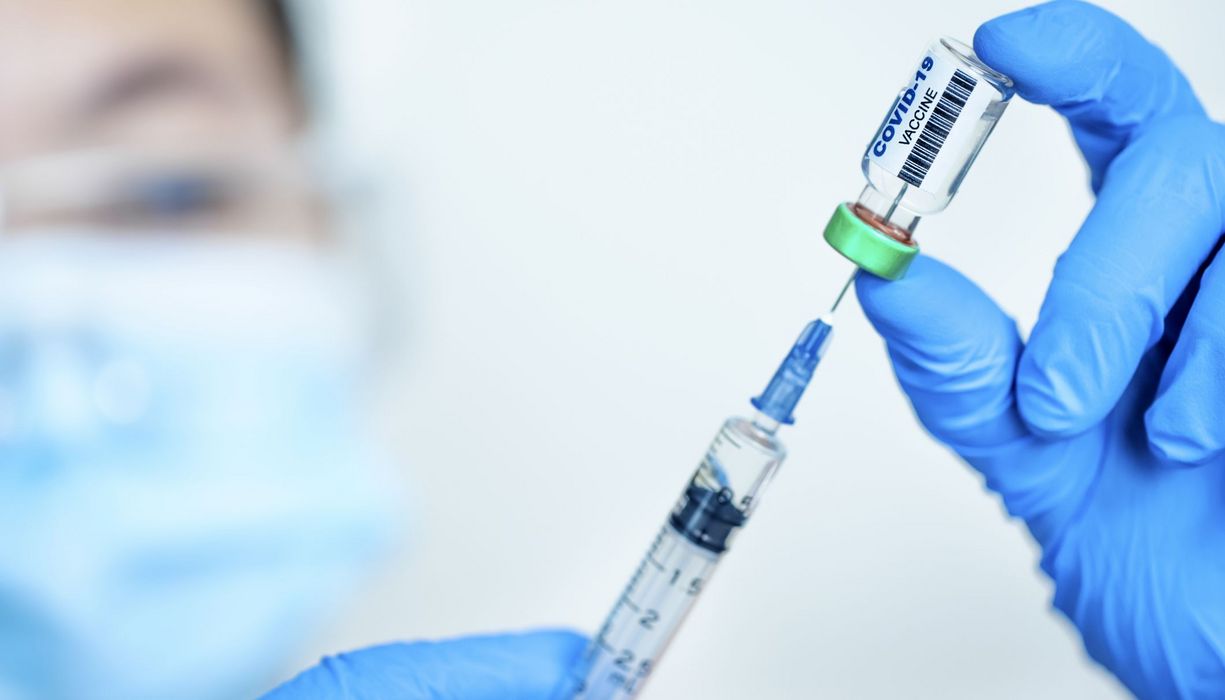
© Tomwang112/iStockphoto
Nuvaxovid (NVX-CoV2373) enthält eine modifizierte Form des Spike-Proteins von SARS-CoV-2, die im Labor hergestellt wurde, sowie ein Hilfsstoff (Adjuvans). Wird die Vakzine verimpft, erkennt das Immunsystem das fremde Protein und bildet Antikörper und T-Zellen dagegen. Das Impfschema besteht aus zwei Impfungen im Abstand von drei Wochen. Die bedingte Zulassung soll für Personen ab 18 Jahre gelten.
In zwei großen klinischen Studien mit insgesamt mehr als 45.000 erwachsenen Teilnehmern erhielten die Probanden entweder zwei Dosen Nuvaxovid oder Placebo. In der ersten Studie, die in den USA und Mexiko stattfand, konnte die Impfung die Anzahl symptomatischer Covid-19-Erkrankungen um 90,4 Prozent reduzieren (14 Fälle unter 17.312 Geimpften versus 63 Fälle unter 8140 Placebo-Geimpften). In der zweiten Studie, durchgeführt in Großbritannien, lag die Risikoreduktion fast identisch bei 89,7 Prozent. Damit liegt die Schutzwirkung vergleichbar hoch zu denen der Zulassungsstudien der mRNA-Impfstoffe Comirnaty® und Spikevax®.
Laut EMA waren während des Studienzeitraums der Original-Virusstamm (Wuhan-Variante) sowie einige bedenkliche Virusvarianten wie Alpha und Beta die dominierenden Stämme. Ob Nuvaxovid auch vor der Omikron-Variante schützt, ist noch unklar.
Die Nebenwirkungen waren meistens mild und moderat und verschwanden einige Tage nach der Impfung. Am häufigsten kam es zu Schwellung und Schmerzen an der Einstichstelle im Oberarm, Müdigkeit, Muskelschmerzen, Kopfschmerzen, einem generellen Unwohlsein, Gelenkschmerzen sowie Übelkeit oder Erbrechen.
Das könnte Sie auch interessieren
Medikamente ohne Zuzahlung
Alle zwei Wochen neu: die aktuelle Liste der zuzahlungsfreien Arzneimittel.
Arzneimitteldatenbank
Medikamenten-Name oder Wirkstoff eingeben für mehr Informationen.
Podcast "gecheckt!"
Podcast: Auch Männer sorgen vor
Männer gelten als Vorsorgemuffel in Sachen Gesundheit. Jedoch existieren spezielle Angebote, die…
Aktuelle Nachrichten
aus Apotheke, Forschung und Gesundheitspolitik.
Krankheiten von A - Z
In diesem Lexikon finden Sie umfassende Beschreibungen von etwa 400 Krankheitsbildern